SEGUNDA LEY DE LA TERMODINÁMICA
Enunciado de Clausius
No es posible un proceso cuyo único resultado sea la transferencia de calor de un cuerpo de menor temperatura a otro de mayor temperatura.
Enunciado de Kelvin-Planck
No es posible un proceso cuyo único resultado sea la absorción de calor procedente de un foco y la conversión de este calor en trabajo.
Equivalencia entre el enunciados de Clausius y de Kelvin-Planck
Las dos figuras que vienen a continuación nos muestran de forma gráfica la equivalencia de los enunciados de Clausius y de Kelvin-Planck.El conjunto de una máquina que transfiera calor del foco frío al caliente (Clausius) combinado con un motor nos dan como resultado una máquina que absorbe calor de una sola fuente y lo transforma íntegramente en trabajo (Kelvin-Planck).
Trascendencia de la segunda ley de la termodinámica
Es preciso reconocer que las ciencias naturales han ido creando conceptos en los últimos dos siglos que se han alejado del saber común, el que todos los ciudadanos con alguna cultura sustentan en cualquier país. A los estudiantes de preuniversitario casi siempre les resulta extraño y difícil de racionalizar el concepto de “entropía”. Al final se conforman con que el profesor les diga: “entiéndanlo como una medida del desorden”. A partir de ahí, hasta los padres le pueden decir a la alumna o el alumno: ”¡qué entropía tienes en tus papeles!”, para denostar su caos documentario. La entropía y la Segunda Ley de la Termodinámica no son conceptos de fácil popularización, a pesar de su enorme importancia para nuestra vida en el mundo actual.
En realidad la entropía solo en alguna medida se puede igualar al desorden. A lo que si se puede hacer bastante parecido es a la diversidad. Una de las formas de expresar la famosa Segunda Ley de la Termodinámica es que “cualquier proceso natural espontáneo aumenta la entropía del sistema”. Y es que lo que denominamos como la entropía de cualquier sistema material depende de la cantidad de estados posibles en el que puede o tiene probabilidades de existir. Quiere decir que si un proceso es espontáneo, o sea, que ocurre sin realizar trabajo externo alguno sobre él que lo facilite, su evolución marcha siempre en la dirección de aumentar sus probabilidades de existencia y estabilidad.Y eso implica que tenga que emplear la mínima energía para seguir evolucionando y aumentando sus diferentes formas de existir establemente.
Existen muchos ejemplos que podrían ilustrar esta lógica natural con hechos de la vida diaria. Siempre buscamos la parada de ómnibus por donde pasan más rutas que nos llevan a un destino, logrando así con la diversidad una mayor probabilidad de llegar lo antes posible. También, un charco de agua se evapora espontáneamente, y entre los factores que influyen en esto está que una molécula de agua como vapor es más libre, tiene más trayectorias posibles y hasta se asocia más variadamente con otras que cuando está relacionada con sus vecinas en una masa líquida.
La diversidad es más probable y estable que la uniformidad, al menos en la naturaleza. ¿Lo será también en la vida social y productiva de un país?
Es justo plantearse que la propiedad que se ejerza sobre un sistema de producción de valor, que puede ser una empresa, debería ser esencialmente colectiva, de toda la sociedad. Esto evita que la riqueza se concentre en unos pocos que entonces puedan determinar la política de un país para su conveniencia. La propiedad colectiva sobre los medios fundamentales de producción de valor hace entonces muy importante que la estructura y las interrelaciones entre los procesos de esas empresas sean diseñados para que rindan lo máximo a sus dueños, que son todos los ciudadanos. Esto es también es válido para cualquier organización pública importante. Una referencia a los actores, representantes de la sociedad, que deben realizar tal tarea implicaría otro escenario y otras argumentaciones, fuera del alcance de esta breve nota.
Es justo plantearse que la propiedad que se ejerza sobre un sistema de producción de valor, que puede ser una empresa, debería ser esencialmente colectiva, de toda la sociedad. Esto evita que la riqueza se concentre en unos pocos que entonces puedan determinar la política de un país para su conveniencia. La propiedad colectiva sobre los medios fundamentales de producción de valor hace entonces muy importante que la estructura y las interrelaciones entre los procesos de esas empresas sean diseñados para que rindan lo máximo a sus dueños, que son todos los ciudadanos. Esto es también es válido para cualquier organización pública importante. Una referencia a los actores, representantes de la sociedad, que deben realizar tal tarea implicaría otro escenario y otras argumentaciones, fuera del alcance de esta breve nota.
Pero cabe preguntarnos, ¿es solo la uniformidad y el inmovilismo lo que da estabilidad a las instituciones que pertenecen al pueblo? Las tendencias administrativas comunes conducen a que todo el que produzca algo específico, digamos tuercas, en un estado socialista, debe estar bajo un mismo mando, vertical. Esto da lugar a una “Empresa Nacional de Tuercas” u otra “Empresa Municipal de Pizzerias”. También puede ocurrir que todos los objetos culturales y patrimoniales de una provincia se decida colocarlos en un solo museo de la capital provincial. Son muchos los argumentos de racionalidad económica y ahorro que pueden justificar esas estructuras. Generalmente, las situaciones excepcionales obligan a tales centralizaciones y uniformidades para lograr el éxito. Se cuenta que Fidel llegó a necesitar controlar centralmente el número de proyectiles de cada combatiente en algún momento crítico de la guerrilla en la Sierra Maestra. La historia enseña que tanto la Unión Soviética como los Estados Unidos concentraron en el gobierno las decisiones de la producción en la industria de la guerra durante la última conflagración mundial. En todos estos casos extremos se tuvo éxito gracias a estas medidas.
Sin embargo, la experiencia muestra que en situaciones de desenvolvimiento normal de una sociedad, aún con restricciones externas, la uniformidad y la centralización pueden conducir al inmovilismo, al estancamiento, a la corrupción y al fracaso. Un caso paradigmático ocurrió en los Estados Unidos al final del siglo XIX y principios del XX. La Standard Oil Co. se había convertido en el primer gran monopolio de producción y comercialización de portadores de energía, aparente y mediáticamente muy exitoso. Su crecimiento y absorción de actividades de empresas menores fue tal que para muchos se situó abiertamente por encima de la ley e impidió que las iniciativas innovadoras de otras pequeñas empresas progresaran. En el proceso que condujo a la Corte Suprema de los EEUU a fraccionar este monopolio en 1911 aparecieron incluso alegaciones de graves hechos de corrupción.
En la Unión Soviética ocurrió que el académico Trofim Lysenko desarrolló en los años 30 del siglo XX ciertas teorías, de comprobación incierta y pseudocientífica, para la producción agrícola que condujeron a una concepción de la “herencia adquirida del ambiente” en los sistemas vivos. Estas fueron extrapoladas central y políticamente como supuestas leyes “materialistas” de la naturaleza, contrapuestas a las “idealistas” de Mendel, en boga entonces en la ciencia moderna. La triste historia de estos eventos y de la centralización del sistema científico de Lysenko no cabe en estas líneas. Solo referiremos que le costaron a la Unión Soviética quedar a la saga absoluta en el desarrollo de la biología en los años en los que la humanidad descubrió y desarrolló los principales conocimientos actuales acerca del origen molecular de la vida. El uso del saber científico en este campo ha permitido que en este mundo convivan hoy más de siete mil millones de habitantes.
Vistos estos razonamientos, sería excelente desarrollar ideas acerca de si las organizaciones socialistas, propiedad de todo el pueblo, deben seguir o no, con o sin excepciones, una de estas alternativas. Por una parte la centralizadora y uniforme, como demuestra el éxito en situaciones excepcionales, y por otra la diversa y competitiva como fórmula de estabilidad y progreso, igual que funciona en la naturaleza la Segunda Ley de la Termodinámica. Lo único que debería estar excluido es creernos que una sola de esas fórmulas, la uniforme y centralizada o la diversa y competitiva, es la única que debemos tomar. Sería como negarnos a progresar y destinarnos al fracaso.
Procesos reversibles y los irreversibles
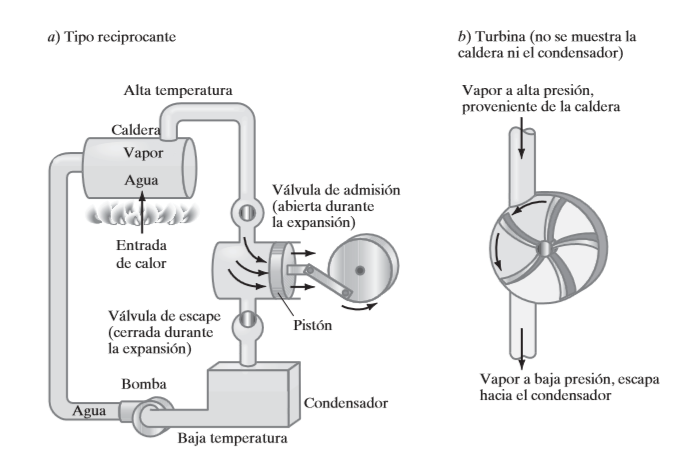
La segunda ley de la termodinámica establece que ninguna máquina térmica puede tener una eficiencia de 100 por ciento. Entonces cabe preguntar, ¿cuál es la eficiencia más alta que pudiera tener una máquina térmica? Antes de contestarla es necesario definir primero un proceso idealizado, llamado proceso reversible.
Un proceso reversible se define como un proceso que se puede invertir sin dejar ningún rastro en los alrededores como se muestra en la figura.
 Los procesos que no son reversibles se denominan irreversibles.
Los procesos que no son reversibles se denominan irreversibles.
Los procesos reversibles en realidad no ocurren en la naturaleza, sólo son idealizaciones de procesos reales. Los reversibles se pueden aproximar mediante dispositivos reales, pero nunca se pueden lograr; es decir, todos los procesos que ocurren en la naturaleza son irreversibles.
Los ingenieros están interesados en procesos reversibles porque los dispositivos que producen trabajo, como motores de automóviles y turbinas de gas o vapor, entregan el máximo de trabajo, y los dispositivos que consumen trabajo, como compresores, ventiladores y bombas, consumen el mínimo de trabajo cuando se usan procesos reversibles en lugar de irreversibles.
 Irreversibles
Irreversibles
Los factores que causan que un proceso sea irreversible se llaman irreversibilidades, las cuales son la fricción, la expansión libre, el mezclado de dos fluidos, la transferencia de calor a través de una diferencia de temperatura finita, la resistencia eléctrica, la deformación inelástica de sólidos y las reacciones químicas.
La fricción es una forma familiar de irreversibilidad relacionada con cuerpos en movimiento La fricción es una forma familiar de irreversibilidad relacionada con cuerpos en movimiento.
 En cambio, algo más del trabajo se convierte en calor mientras se vencen las fuerzas de fricción que también se oponen al movimiento inverso. Dado que el sistema (los cuerpos en movimiento) y los alrededores no pueden ser regresados a sus estados originales, este proceso es irreversible. Mientras más grandes sean las fuerzas de fricción, más irreversible es el proceso.
En cambio, algo más del trabajo se convierte en calor mientras se vencen las fuerzas de fricción que también se oponen al movimiento inverso. Dado que el sistema (los cuerpos en movimiento) y los alrededores no pueden ser regresados a sus estados originales, este proceso es irreversible. Mientras más grandes sean las fuerzas de fricción, más irreversible es el proceso.
La segunda forma de irreversibilidad es la expansión libre de un gas, el cual se halla separado de un vacío mediante una membrana, (como se ilustra en la figura 2). Cuando se rompe la membrana, el gas llena todo el recipiente y la única forma de restaurar el sistema a su estado original es comprimirlo a su volumen inicial, transfiriendo calor del gas hasta que alcance su temperatura inicial. De las consideraciones de conservación de la energía, se puede demostrar sin dificultad que la cantidad de calor transferida del gas es igual a la cantidad de trabajo que los alrededores realizan sobre el gas. La restauración de los alrededores requiere convertir por completo este calor en trabajo, lo cual violaría la segunda ley. Por lo tanto, la expansión libre de un gas es un proceso irreversible.
 Una tercera forma de irreversibilidad conocida es la transferencia de calor (proceso que ocurre cuando hay una diferencia de temperatura, entre un sistema y sus alrededores) debida a una diferencia finita de temperatura. La única forma de invertir este proceso y restablecer la temperatura es proporcionarle refrigeración, lo cual requiere algo de entrada de trabajo. Cuando esto sucede el proceso vuelve a su estado original menos sus alrededores. La energía interna de éstos se incrementa en una cantidad igual en magnitud al trabajo suministrado al refrigerador y para restablecer los alrededores a su estado inicial sólo es posible si se convierte este exceso de energía interna completamente en trabajo, lo cual es imposible sin violar la segunda ley. Como el sistema y los alrededores, puede ser restablecido a su condición inicial, la transferencia de calor ocasionada por una diferencia finita de temperatura es un proceso irreversible. 🔀
Una tercera forma de irreversibilidad conocida es la transferencia de calor (proceso que ocurre cuando hay una diferencia de temperatura, entre un sistema y sus alrededores) debida a una diferencia finita de temperatura. La única forma de invertir este proceso y restablecer la temperatura es proporcionarle refrigeración, lo cual requiere algo de entrada de trabajo. Cuando esto sucede el proceso vuelve a su estado original menos sus alrededores. La energía interna de éstos se incrementa en una cantidad igual en magnitud al trabajo suministrado al refrigerador y para restablecer los alrededores a su estado inicial sólo es posible si se convierte este exceso de energía interna completamente en trabajo, lo cual es imposible sin violar la segunda ley. Como el sistema y los alrededores, puede ser restablecido a su condición inicial, la transferencia de calor ocasionada por una diferencia finita de temperatura es un proceso irreversible. 🔀 Ciclo de Carnot
Procesos
Para conseguir la máxima eficiencia la máquina térmica que estamos diseñando debe tomar calor de un foco caliente, cuya temperatura es como máximo Tc y verter el calor de desecho en el foco frío, situado como mínimo a una temperatura Tf.
Para que el ciclo sea óptimo, todo el calor absorbido debería tomarse a la temperatura máxima, y todo el calor de desecho, cederse a la temperatura mínima. Por ello, el ciclo que estamos buscando debe incluir dos procesos isotermos, uno de absorción de calor a Tc y uno de cesión a Tf.
Para conectar esas dos isotermas (esto es, para calentar el sistema antes de la absorción y enfriarlo antes de la cesión), debemos incluir procesos que no supongan un intercambio de calor con el exterior (ya que todo el intercambio se produce en los procesos isotermos). La forma más sencilla de conseguir esto es mediante dos procesos adiabáticos reversibles (no es la única forma, el motor de Stirling utiliza otro método, la recirculación). Por tanto, nuestra máquina térmica debe constar de cuatro pasos:
- C→D Absorción de calor Qc en un proceso isotermo a temperatura Tc.
- D→A Enfriamiento adiabático hasta la temperatura del foco frío, Tf.
- A→B Cesión de calor | Qf | al foco frío a temperatura Tf.
- B→C Calentamiento adiabático desde la temperatura del foco frío, Tf a la temperatura del foco caliente, Tc.
Gases ideales
Para un sistema de este tipo los cuatro pasos son los siguientes:
- Expansión isoterma C→D
- El gas se pone en contacto con el foco caliente a Tc y se expande lentamente. Se extrae trabajo del sistema, lo que provocaría un enfriamiento a una temperatura ligeramente inferior a Tc, que es compensado por la entrada de calor Qc desde el baño térmico. Puesto que la diferencia de temperaturas entre el baño y el gas es siempre diferencial, este proceso es reversible. De esta manera la temperatura permanece constante. En el diagrama pV, los puntos de este paso están sobre una hipérbola dada por la ley de los gases ideales.

- Compresión isoterma A→B
- Una vez que ha alcanzado la temperatura del foco frío, el gas vuelve a ponerse en contacto con el exterior (que ahora es un baño a temperatura Tf). Al comprimirlo el gas tiende a calentarse ligeramente por encima de la temperatura ambiente, pero la permeabilidad de las paredes permite evacuar calor al exterior, de forma que la temperatura permanece constante. Esta paso es de nuevo una hipérbola según la lay de los gases ideales.
Ciclo Stirling
El ciclo de Stirling es un ejemplo, como el ciclo de Carnot de ciclo completamente reversible y que por tanto alcanza el máximo rendimiento que permite el Segundo Principio de la Termodinámica.
Se trata de un ciclo altamente ideal cuya realización práctica, incluso en forma aproximada entraña serias dificultades. No obstante, en los últimos años ha adquirido relevancia con el desarrollo de motores de Stirling, que funcionan de manera aproximada según este ciclo.
Descripción del ciclo
Un ciclo de Stirling ideal se compone de cuatro procesos reversibles:
- Compresión isoterma A→B
- El gas se comprime desde un volumen inicial VA hasta uno final VB, inferior, manteniendo su temperatura constante en un valor T1 (a base de enfriar el gas de forma continuada).
- Calentamiento a volumen constante B→C
- El gas se calienta desde la temperatura T1 a la temperatura T2 mantenientdo fijo su volumen.
- Expansión isoterma C→D
- El gas se expande mientras se le suministra calor de forma que su temperatura permanece en su valor T2.
- Enfriamiento isócoro D→A
- Se reduce la temperatura del gas de nuevo a su valor T1 en un proceso a volumen constante.
- Ciclo de Ericsson
- En este ciclo termodinámico, también reversible y por tanto nos da el rendimiento máximo que se puede obtener de la máquina, el fluido evoluciona realizando dos transformaciones isotermas y dos isobáricas, tal como se puede observar en la figura adjunta:
-
Al introducir el Segundo Principio de la termodinámica, se formulan varios enunciados que, aunque poseen validez general, están expresados en términos de máquina térmica. Los más importantes de estos enunciados son:
- Enunciado de Kelvin-Planck
- No puede construirse un dispositivo que, operando en un ciclo, tenga como único resultado la absorción de calor de un solo foco y la producción de una cantidad equivalente de trabajo.
- Enunciado de Clausius
- Es imposible construir un dispositivo que, operando cíclicamente, tenga como único resultado el paso de calor de un foco frío a uno caliente.
- Teorema de Carnot
- El rendimiento de una máquina térmica irreversible que funcione entre dos temperaturas es siempre menor que el de una máquina térmica reversible que funcione entre las mismas temperaturas.
Estos tres enunciados son bastante “concretos” en cuanto a que hablan de procesos y dispositivos fácilmente interpretables. No obstante, el segundo principio de la termodinámica puede enunciarse de formas más abstractas que, si bien requieren un mayor esfuerzo para su interpretación, ponen de manifiesto de forma más clara la validez universal de esta ley.
Uno de estos enunciados, que es el que se trata en este artículo es la
- Desigualdad de Clausius
- Para todo proceso cíclico
- cumpliéndose la desigualdad si el proceso es irreversible, y la igualdad si es reversible.
- Ecuaciones Tds
Ecuaciones Gibbsianas
http://fis.ucv.cl/ayudantia/termo/7_ecuaciones_Gibbs.pdfdejo un link para el tema de ecuaciones Gibbsianas.
Máquinas térmicas y segunda ley de la termodinámica










Refrigerador
Un refrigerador es un dispositivo que extrae calor de un foco que está más frío que el ambiente (como el interior de un frigorífico, a 5°C) y lo vierte en el ambiente (a 22°C, por ejemplo). Para funcionar, un refrigerador requiere un trabajo adicional Win, que aumenta el calor de desecho Qoutque se entrega al ambiente.
Un frigorífico o un aparato de aire acondicionado son ejemplos de refrigeradores. En su uso habitual, lo que hacen los refrigeradores y aparatos de aire acondicionado es principalmente, mantener constante la temperatura del interior de una cámara o habitación, expulsado de forma continua el calor que va entrando por las paredes (aparte, si se introduce un objeto caliente en un frigorífico, éste se encarga de bajar la temperatura del objeto, consumiendo un trabajo adicional).
Ambos operan sobre el mismo principio. Un compresor eleva la temperatura del fluido de trabajo a base de realizar trabajo sobre él. El fluido, a temperatura superior a la ambiente, es puesto en contacto con éste en un condensador (una rejilla,p.ej.), liberando calor Qout. El fluido enfriado, pasa por una válvula de expansión, donde su temperatura cae por debajo de la del foco frío. Puesto en contacto con este foco (la cámara frigorífica o la habitación) mediante otra rejilla conocida como evaporador, absorbe calor de éste, Qin. De ahí vuelve al compresor, recomenzando el ciclo.
Para los refrigeradores se define el coeficiente de desempeño (COPR) según el mismo principio que para las máquinas térmicas siendo “lo que se saca” el calor Qin que se extrae del foco frío y “lo que cuesta” el trabajo Win necesario para ello
A diferencia del rendimiento de una máquina térmica, el coeficiente de desempeño puede ser mayor que la unidad (normalmente lo es, de hecho).
Dado que refrigeradores y bombas de calor operan en ciclos, el coeficiente de desempeño puede definirse en términos de los flujos de calor y trabajo
donde cada flujo se calcula dividiendo el calor o trabajo intercambiados en un ciclo dividido por el periodo de éste.
En el diseño de refrigeradores se suele usar como unidad la frigoría (fg), definida como 1 kcal (= 4186 J) de calor extraído. También, como unidad de potencia, se usa la frigoría/hora (fg/h), llamada erróneamente como frigoría a secas, que nos da el flujo de calor extraído.
Bomba de calor
Una bomba de calor se basa en el mismo principio que un refrigerador, salvo que se emplea para pasar calor del ambiente a un foco más caliente, como una habitación, para caldearla. Para esto el, circuito debe estar situado de manera opuesta al caso del refrigerador. El compresor envía el fluido a alta presión al un condensador en el interior de la habitación, donde libera calor por estar a más temperatura que el ambiente. pasa entonces por la válvula hacia el exterior, donde se evapora y cae por debajo de la temperatura exterior, absorbiendo calor en el evaporador. Vuelve entonces al compresor, reiniciando el ciclo.
En el uso habitual, lo que hace una bomba de calor es principalmente mantener constante la temperatura del interior de una cámara o habitación, reintroduciendo de forma continua el calor que va escapando por las paredes (aparte, si se introduce un objeto frío en una habitación, la bomba de calor se encarga de elevar la temperatura del objeto, consumiendo un trabajo adicional).
En el caso límite de una estufa (de resistencia eléctrica, por ejemplo), lo que ocurre es que no se extrae calor del exterior y todo el calor que entra en la habitación procede del trabajo consumido.
Para que un mismo aparato pueda funcionar como aire acondicionado en verano y bomba de calor en invierno, es necesario un sistema de válvulas que permita que el vapor fluya en direcciones opuestas según el uso que se le de.
En el caso de una bomba de calor “lo que se saca” es el calor Qout, por lo que el coeficiente de desempeño de una bomba de calor se define como
o, empleando los flujos de calor y trabajo
De esta definición se tiene que el coeficiente de desempeño de una bomba de calor y del refrigerador correspondiente se diferencian en 1.
y por tanto el coeficiente de desempeño de una bomba de calor es como mínimo 1. Un valor de 1 quiere decir que no se extrae ningún calor del foco frío, sino que simplemente se transforma trabajo en calor. Esto es lo que hace, por ejemplo, una estufa de resistencia.
Para una bomba de calor real el COP puede ser de 4. Esto quiere decir que para aportar 4 J de calor a una habitación solo consume 1 J de energía eléctrica (mientras que una estufa consumiría los 4 J). Las bombas de calor son por tanto más eficientes como sistema de calefacción, pero requieren instalaciones más grandes y poseen problemas de funcionamiento si la temperatura exterior es demasiado baja.
La escala termodinamica de la temperatura de daszemog



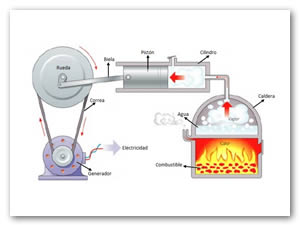

La igualdad anterior representa el Teorema de Clausius y sólo se aplica al ciclo ideal o ciclo Carnot. Puesto que la integral representa el cambio neto en la entropía en un ciclo completo, al ciclo de motor más eficiente se le atribuye un cambio de entropía cero.
La desigualdad de Clausius se aplica a cualquier motor de ciclo real y supone para el ciclo un cambio negativo de la entropía. Es decir, la entropía dada al medio ambiente durante el ciclo, es más grande que la entropía transferida por el calor del foco caliente al motor. En el motor térmico simplificado, donde se añade todo el calor QH a la temperatura TH, entonces para completar el ciclo se añade al sistema una cantidad de entropía ΔS = QH/TH, que se obtiene del medio ambiente. En general, la temperatura del motor será menor que TH al menos durante la parte del tiempo en que se está añadiendo calor, y cualquier diferencia de temperatura supone un proceso irreversible. En cualquier proceso irreversible se crea un exceso de entropía, y por tanto se debe arrojar mas calor al foco frío, para deshacerse de esta entropía. Esto deja menos energía para realizar trabajo.
La máquina térmica de Carnot.
Toda máquina térmica requiere para su funcionamiento al menos de dos fuentes de calor a diferentes temperaturas. La máquina funcionará tomando calor de la fuente de mayor temperatura, producirá trabajo y entregará calor a la fuente de menor temperatura.
El esquema representativo de una máquina térmica que funciona de acuerdo con el enunciado de Carnot del segundo principio se indica en la siguiente figura.
El esquema representativo de una máquina térmica que funciona de acuerdo con el enunciado de Carnot del segundo principio se indica en la siguiente figura.

Siendo su rendimiento.



El Teorema y la Desigualdad de Clausius
La desigualdad de Clausius se aplica a cualquier motor de ciclo real y supone para el ciclo un cambio negativo de la entropía. Es decir, la entropía dada al medio ambiente durante el ciclo, es más grande que la entropía transferida por el calor del foco caliente al motor. En el motor térmico simplificado, donde se añade todo el calor QH a la temperatura TH, entonces para completar el ciclo se añade al sistema una cantidad de entropía ΔS = QH/TH, que se obtiene del medio ambiente. En general, la temperatura del motor será menor que TH al menos durante la parte del tiempo en que se está añadiendo calor, y cualquier diferencia de temperatura supone un proceso irreversible. En cualquier proceso irreversible se crea un exceso de entropía, y por tanto se debe arrojar mas calor al foco frío, para deshacerse de esta entropía. Esto deja menos energía para realizar trabajo.
Entropía.
En física, se habla de entropía (usualmente simbolizada con la letra S) para referirnos al grado de equilibrio de un sistema termodinámico, o más bien, a su nivel de tendencia al desorden (variación de entropía). Así, cuando se produce una variación de entropía positiva, los componentes de un sistema tienden más al desorden que cuando se produce una entropía negativa.
La entropía es un concepto clave para la Segunda Ley de la termodinámica, que reza que “la cantidad de entropía en el universo tiende a incrementarse en el tiempo”. O lo que es igual: dado un período de tiempo suficiente, los sistemas tenderán al desorden. Y dicho potencial de desorden será mayor en la medida en que más próximo al equilibrio se halle el sistema. A mayor equilibrio, mayor entropía.
También podría decirse que la entropía no es más que el cálculo de la energía interna de un sistema que no es útil para realizar un trabajo, pero que existe y se acumula en un sistema determinado. Es decir, la energía excedente, desechable.
Así, cuando un sistema pasa de un estado inicial a uno secundario, en un proceso isotérmico (de igual temperatura), la entropía vendrá a ser igual a la cantidad de calor que intercambie el sistema con el medio ambiente, dividido por su temperatura absoluta. Esto se expresa según la siguiente ecuación:
S2 – S1 = Q1→2 / T
Ello demuestra que sólo se pueden calcular las variaciones de la entropía en un sistema, y no valores absolutos. El único punto en donde la entropía es nula es en el cero absoluto (0 K o -273,16 °C).
Puede servirte: Entalpía.











Comentarios
Publicar un comentario